
توجه مهم : این بخش هیچ ارتباطی با دوره نخبگان شیمی ندارد و تنها جنبه تعاملی برای اعضای سایت را دارد (یعنی بخشی از محتوای نوشتاری رایگان سایت می باشد)
شرایط پاسخگویی به سوالات:
1- برای پرسیدن سوالتان لطفا در بخش «ورود یا عضویت» اطلاعات کاربری خود را وارد کرده و سپس مجددا به این صفحه مراجعه نمایید تا بتوانید سوالتان را بپرسید.
2- با کمال احترام به سوالات درسی تکراری پاسخ داده نخواهد شد، بنابراین لطفا قبل از پرسیدن سوال ارزشمندتان ، به سوالاتی که سایر دوستان پرسیده اند توجه کنید.
3- پاسخ خیلی از سوالات کوتاه ، در ویدیوهای آموزشی رایگان سایت قرار گرفته است. در صورتی که پاسخ سوالتان در داخل ویدیوهای آموزشی وجود داشته باشد، به آن سوال نیز پاسخ داده نخواهد شد. پس لطفا قبل از پرسش، ویدیوهای آموزشی رایگان سایت را مشاهده کنید.
4- سوالات که جنبه تخصصی داشته باشد و مربوط به محتوای دوره پیشرفته نخبگان شیمی باشد، پاسخ داده نخواهد شد (به احترام شرکت کنندگان این دوره)
5- به سوالات محاسباتی نیز پاسخ داده نمیشود اما نکات مربوط به حل مسائل پاسخ داده خواهد شد.
با تشکر از شما دوست ارزشمندمان…
لطفا سوال خود را در کادر زیر بنویسید، در صورتی که سوالتان شرایط بالا را داشته باشد پس از 24 الی 48 ساعت آینده به آن پاسخ داده خواهد شد.
توجه : سوالات شما پس از تایید، منتشر خواهد شد
برای اینکه در این صفحه، نظر خود را ثبت کنید و یا سوالتان را بپرسید ابتدا باید وارد حساب کاربریتان شوید. در صورتی که حساب کاربری ندارید در سایت عضو شوید. جهت ثبت نام یا ورود اینجا کلیک کنید
2. شبه فلزات آنیون می دهند یا کاتیون؟
3. ظرفیت نیکل برای فرمول نویسی
5. تفاوت بین فرمول شیمیایی،فرمول مولکولی،فرمول ساختاری و فرمول تجربی
6. منظور از «چند عنصر جدول تناوبی به زیر لایه s ختم شده» چیست؟
7. دمای کلوین و سانتی گراد در یکای ظرفیت گرمایی ویژه
8. جمله عمومی ظرفیت زیر لایه ها(حداکثر تعداد الکترون ها در هر زیرلایه)
9. تعیین شمار پیوندهای دوگانه در ترکیبات بزرگ
10. آرایش الکترون-نقطه ای برای گروه 12
11. تفاوت یونش با انحلال مولکولی و یونی
13. تغییر رسانایی آب پس از اضافه شدن حل شونده
14. برابر شدن سرعت رفت و برگشت در واکنش های تعادلی
15. آیا پیوند های دوگانه و سه گانه گروه عاملی محسوب می شوند؟
17. علت قرار گیری هلیم در گروه 18
18. ثابت تعادل برای اسیدها و بازهای قوی
19. حجم مولی ۲۲/۴L برای شرایط STP و غیرSTP
20. علت بیشتر بودن واکنش پذیری Zn از Fe
21. عدم استفاده از پیشوند یونانی برای برخی ترکیبات مولکولی
22. مواد جامد و مایع چرا حجم مولی ندارند؟
23. خواص شیمیایی عنصرها در هر گروه یکسان است یا مشابه؟
24. تیغه فلزی کاتد چگونه می تواند الکترون بگیرد؟
25. تفاوت پیوند کووالانسی، واندروالسی و هیدروژنی
26. پیوند چهارگانه در مولکول دواتمی کربن
27. نقشه پتانسیل الکتروستاتیکی
29. استثنا در فرمول عمومی کتون ها و سایر گروه های عاملی
31. معنای جابه جا شدن تعادل به چپ یا راست
34. فرمول ترکیبات هیدروژن دار گروه ۱۶
35. تفاوت جرم اتمی میانگین به دست اومده توسط ما با جرم اتمی میانگین در جدول تناوبی
36. نحوه بدست آوردن سریع تعداد الکترون های اشتراکی و پیوند ها در یک ترکیب
37. مقایسه خصلت فلزی در گروه ها و دوره های مختلف
38. شماره گذاری آلکان های شاخه دار
39. حجم مولی گاز ها در مسائل استوکیومتری
40. موازنه نبودن برخی واکنش ها
41. پیش نیازهای فصل 1 شیمی دوازدهم
42. آیا همه مولکول های آلی، دو بخش قطبی و ناقطبی دارند؟
43. منظور از حل شدن بخش قطبی صابون در آب
44. مسائل استوکیومتری با دو بازده درصدی
45. واکنش SO3 + H2O چه قاعده ای دارد؟

سلام استاد وقتتون بخیر . ببخشید سلول نور – الکتروشیمیایی که در آخر تمرینات دوره ای فصل دوم هست رو میشه یه کم توضیح بدید . ممنون میشم
سلام به شما دوست خوبم.

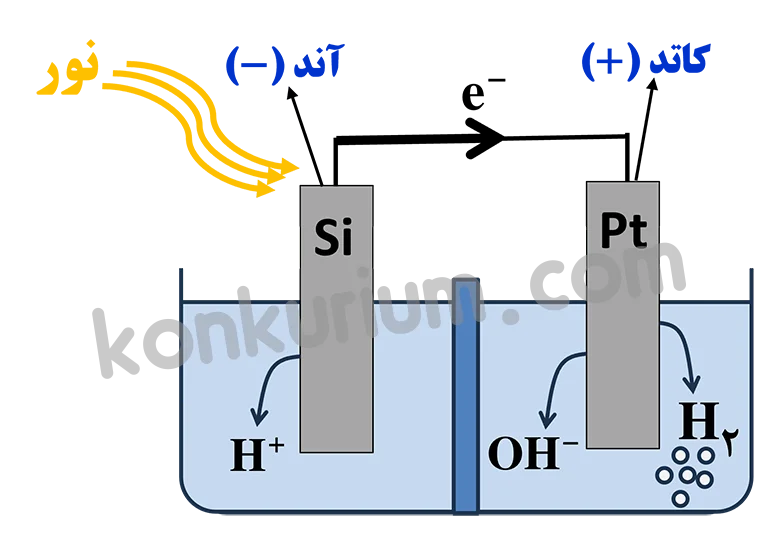

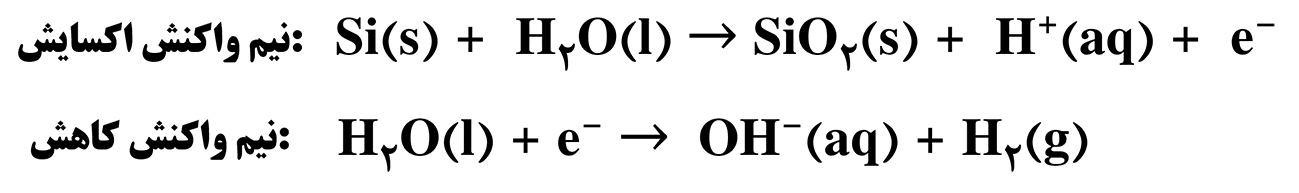
سلول نورالکتروشیمیایی یک سلول گالوانی هست و برای انجام واکنش اکسایش و کاهش در این نوع سلول از نور استفاده میشه. یکی از مشکلاتی که توی بحث سلول های سوختی مطرح بود، کمبود گاز هیدروژن بود که برای تهیه گاز هیدروژن از برقکافت آب استفاده می کردیم ولی برقکافت آب نیاز به هزینه و انرژی زیادی داشت. اما سلول نورالکتروشیمیایی میتونه با کمترین هزینه و از طریق انرژی پاک و تجدید پذیر نور خورشید برامون گاز هیدروژن تولید کنه.
سلول نورالکتروشیمیایی از دو تیغه سیلیسیمی و پلاتینی تشکیل شده که هر دو تیغه در آب قرار گرفتن. زمانی که نور به تیغه سیلیسیمی برخورد می کنه، سیلیسیم برانگیخته میشه و با آب واکنش میده در نتیجه عمل اکسایش صورت میگیره بنابراین سیلیسیم نقش آند رو داره. الکترون هم از طریق سیم به سمت پلاتین میره و عمل کاهش در محیط پلاتین انجام میشه. البته خود پلاتین دچار کاهش نمیشه بلکه آبی که در اطراف تیغه پلاتینی هست الکترون رو میگیره و دچار کاهش میشه. در اثر کاهش آب، گاز هیدروژن تولید میشه در نتیجه ما به هدفمون از سلول های نورالکتروشیمیایی که تولید هیدروژن بود میرسیم.
سلام وقت بخیر
یه سوال در مورد نقطه ی جوش مواد داشتم:
طبق کتاب دهم نقطه ی جوش AsH3 از HBr بیشتره
آیا میبایست برای کنکور این رو بدونیم؟
چون هر دو پیوند هیدروژنی ندارن
جرم مولیاشون برابره و هر دو قطبین
باید چطور مقایسشون کنیم؟
پیشاپیش از پاسخگویی و وقتی که برامون گذاشتین ممنونم🌷🌹🌺
سلام وقت شما هم بخیر.
بله در رابطه با HBr و AsH3 باید مقایسه شون رو بلد باشید ولی نیازی به دونستن علتش نیست چون علتش فراتر از حد کتاب هست ولی با این حال علتش رو بهتون میگم که ذهنتون بازتر بشه.
میدونیم هر چه نیروی جاذبه بین مولکولی در یک مولکول قوی تر باشه، نقطه جوش اون مولکول هم بیشتر هست.
نیروهای جاذبه بین مولکولی ای که توی کتاب شیمی دهم بهش اشاره شده یکی پیوند هیدروژنی هست و یکی هم نیروی واندروالسی. اما نکته اینجاست که خود نیروی واندروالسی از انواع مختلفی تشکیل شده مثل نیروی جاذبه دوقطبی-دوقطبی و نیروی لاندون. نیروی جاذبه دوقطبی-دوقطبی فقط بین مولکول های قطبی به وجود میاد ولی نیروی لاندون در همه مولکول ها چه قطبی و چه ناقطبی وجود داره. (برای مثال آب ۸۰ درصد نیروی جاذبه بین مولکولیش پیوند هیدرونیه و ۲۰ درصدش نیروی لاندونه)
نقطه جوش AsH3 و HBr خیلی با هم فاصله ندارن. ولی به هر حال AsH3 به مقدار اندکی نقطه جوش بالاتری نسبت به HBr داره. اما چرا؟ هم HBr و هم AsH3 مولکول های قطبی هستن و نیروهای جاذبه بین مولکولیشون هم شامل نیروی جاذبه دوقطبی-دوقطبی هست و هم نیروی جاذبه لاندون. نیروی جاذبه دوقطبی-دوقطبی در HBr و AsH3 تقریبا نزدیک به هم هست. اون چیزی که باعث تفاوت در جاذبه بین مولکولی اونها میشه نیروهای لاندون هست. گفتیم همه مولکول ها (چه قطبی و چه ناقطبی) نیروهای لاندون هم تشکیل میدن. قدرت نیروی لاندون به تعداد کل الکترون ها و منطقه ای که الکترون ها در اون پخش شدن بستگی داره. هر دو مولکول HBr و AsH3 دارای 36 الکترون هستند، اما در AsH3 الکترون ها در یک منطقه بزرگتر پخش شدن و باعث میشن AsH3 نیروهای لاندون قوی تر و در نتیجه نقطه جوش کمی بالاتری نسبت به HBr داشته باشه.
موفق باشید
سلام استاد وقتتون بخیر
سوال اولم اینه که توی کتاب درسی گفته که یخ ظاهری سخت داره
اما توی درسنامه ی گاج نوشته که یخ سخت هست.
اگر توی یه تست شمارشی گفته بود یخ سخت است و به (ظاهری سخت) اشره نکرد باید این گزینه رو صحیح در نظر بگیریم یا غلط؟
و سوال دومم اینکه آیا سختی مخالف شکننده بودنه؟یا شکنندگی مخالف شکل پذیری است؟
مثلا اگر توی یه جمله گفته بود جامد های کووالانسی شکننده هستند
این جمله صحیح میشه یا غلط؟
ممنونم از لطفتون
با سلام.
کتاب نگفته یخ ظاهراً سخته بلکه گفته یخ ظاهری سخت داره. منظور کتاب از اینکه یخ ظاهر سخت داره اینه که یخ سخت هست. پس در هر صورت جمله رو درست در نظر بگیرید.
در رابطه با سوال دومتون: سختی و شکنندگی ربطی به هم ندارن و دو تا پارامتر مجزا هستن. برای مثال شیشه سخت و شکننده هست اما آهن سخت هست ولی شکننده نیست.
در رابطه با سوال سومتون: شکنندگی و شکل پذیری بر عکس هم هستن.
جامدهای کووالانسی شکننده هستن مثل الماس و گرافیت.
موفق باشید
با سلام و احترام
استاد سوال من اینه که هنگام آزمون ( تستی ) دادن ابتدا باید سراغ کدوم دسته از سوالات رفت ؟
حفظی ها ، مفهومی ها یا مسائل محاسباتی ؟
و اینکه در کل چطور میشه سرعت تست زنی در شیمی رو بالا برد به طوری که بتونیم به طور متوسط هر سوال رو توی یک دقیقه پاسخ بدیم ؟
پیشاپیش از وقت و انرژی و پاسخگویی شما سپاسگزارم
سلام و وقت بخیر. متشکرم
در رابطه با سوال اولتون، اینکه با چه ترتیبی به سوالات آزمون تستی پاسخ بدید، بسته به میزان تسلطتون سلیقه ای هست. بعضی ها به ترتیب دفترچه به سوالات پاسخ میدن بعضی ها هم بین مفاهیم، حفظیات و مسائل اولویت بندی می کنن. اما معیار مهمی که توی پاسخ دادن به سوالات آزمون وجود داره اینه که هر سوالی که احساس می کنید براتون ناآشناست و یا احساس می کنید بیش از یک دقیقه وقت میگیره ازش عبور کنید و در نگاه اول فقط به سوالاتی پاسخ بدید که به اندازه کافی روی اون ها مسلط هستید. و در نهایت زمان باقیمونده رو به بررسی سوالات چالشی اختصاص بدید.
اما در رابطه با سوال دومتون برای اینکه سرعت عملتون توی حل تست ها بالا بره، این موضوع به چهار عامل بستگی داره:
عامل اول مسلط شدن کامل روی مفاهیم شیمی و مرور کافی اون هست. اگر روی مفاهیم به خوبی مسلط نباشید نمی تونید تست ها رو به خوبی تحلیل کنید. پس سعی کنید از درسنامه ای استفاده کنید که بدون اضافه گویی اصل مطلب رو انتقال بده و حجم زیادی نداشته باشه تا بتونید به اندازه کافی مرور کنید.
عامل دوم تحلیل تست های کنکور به صورت تیپ بندی شده هست. قبل از هر تستی باید با ذهنیت طراح کنکور آشنا بشید. چون سایر تست ها عمدتا از تست های کنکور مشتق میشن و بال و پر میگیرن.
عامل سوم تحلیل تست های تالیفی استاندارد هست. منظور از تست تالیفی هر تستی به جز تست های کنکور هست. یکی از منابعی که تست های تالیفی با کیفیتی رو در اختیار شما قرار میده، دفترچه تست های آزمون های آزمایشی هست. البته پاسخنامه این تست ها ضعیفه ولی خود سوالات ارزش بالایی برای بررسی کردن دارن. به خصوص سوالات چالشی و نکته دار این دفترچه ها ذهن شما رو خلاق می کنه.
عامل چهارم قرار گرفتن در شرایط آزمون هست. هر مبحثی رو که می خونید و تست های اون رو به صورت آموزشی کار می کنید حتما از خودتون دو یا سه آزمون بگیرید اون هم به صورت زمان دار؛ مثلا برای یک آزمون 10 سوالی 10 دقیقه وقت تعیین کنید و بعد از 10 دقیقه دست نگه دارید و درصد بگیرید. و در آخر حتما سوالاتی رو که غلط جواب دادید یا اصلا جواب ندادید از روی پاسخنامه بررسی کنید و سپس نقاط ضعفتون رو با مرور عمیق تر مفاهیم و تحلیل تست های بیشتر پوشش بدید. همچنین اگر در شروع راه درصد آزمون هاتون خیلی کم بود، نگران نباشید و ادامه بدید، چون آزمون دادن تا حدودی یک مهارته و باید تکرار رو هم در کنار چهار عاملی که گفتم در نظر بگیرید.
موفق باشید
سلامی دوباره
استاد من این جمله رو متوجه نمیشم ممنون میشم بهم بگید منظورش چیه
“ثابت تعادل میزان پیشرفت واکنش تا رسیدن به تعادل را نشان میدهد”
سلام و وقت بخیر. برای محاسبه ثابت تعادل، با مقدار مواد در لحظه تعادل کار داریم (یعنی مقدار تعادلی مواد).
و برای محاسبه مقدار تعادلی مواد باید مقدار اولیه (مقدار مواد در لحظه شروع) و مقدار تغییرات مواد تا رسیدن به تعادل (یعنی مقدار مصرفی واکنش دهنده ها و تولیدی فرارده ها) رو داشته باشیم. از تفاضل بین مقدار اولیه و مقدار تغییرات مواد تا رسیدن به تعادل، به مقدار تعادلی هر ماده میرسیم، و در نهایت با جایگذاری مقدار تعادلی مواد در فرمول ثابت تعادل، مقدار K به دست میاد. بنابراین برای محاسبه ثابت تعادل هم لحظه شروع مهمه و هم مقدار تغییرات مواد تا رسیدن به تعادل.
به همین دلیل هست که میگیم ثابت تعادل میزان پیشرفت واکنش از لحظه شروع تا لحظه رسیدن به تعادل رو نشان میده. اما با لحظه های بعد از تعادل کاری نداره؛ چون بعد از رسیدن به تعادل، سرعت واکنش های رفت و برگشت برابر میشه و غلظت مواد ثابت می مونه.
این یکی از دلایل برای توجیه جمله شما بود.
موفق باشید
سلام استاد وقتتون بخیر
واکنش SO3 + H2O یه واکنش بی قاعده است درسته؟
چون واکنش ترکیب با ترکیبه و در این نوع واکنش یا جای هیدروژن و فلز عوض میشه یا جای فلز و فلز ولی توی این واکنش فلزی وجود نداره…
استاد چه جور واکنش هایی بی قاعده ان و باید حفظشون کنیم؟
سلام به شما دوست گرامی. این واکنش یک واکنش قاعده دار هست. طبق قاعده ی موجود در فصل اول شیمی دوازدهم، از واکنش اکسید نافلز با آب، اسید تولید میشه. SO3 یک اکسید نافلزه و از واکنشش با آب، سولفوریک اسید تولید میشه. اگر آموزش واکنش نویسی من رو که توی سایت به صورت رایگان قرار گرفته ببینید، تمام واکنش های قاعده دار شیمی دهم و یازدهم توش آموزش داده شده به جز یک سری واکنش ها که قواعدشون مربوط به شیمی دوازدهمه مثل همین واکنش. این قواعد از شیمی دوازدهم توی دوره نخبگان شیمی مفصل تدریس شده، در صورت تمایل می تونید دوره نخبگان دوازدهم رو تهیه کنید و پاسخ سوالتون رو کامل دریافت کنید.
موفق باشید
سلام آقای دانش وقت تون بخیر
ببخشید توی مسائل بازده درصدی، اگه ما دو تا واکنش داشته باشیم که هر دو تا واکنش بازده درصدی داشته باشند، اگه بخوایم از مقدار مصرفی واکنش دهنده واکنش اول به مقدار مصرفی واکنش دهنده واکنش دوم برسیم، مگه نباید بازده در صدی هر دو واکنش رو توی کسر تناسب در هم ضرب کنیم؟ چرا فقط بازده درصدی واکنش اول تاثیر داده میشه؟ واقعاً این قرار دادن بازده درصدی در کسر تناسب توی اینجور مسائل رو یکم بنظرم گیج کننده میشه اگه توضیحش بدید خیلی ممنون میشم
فقط بی زحمت اگه میشه این حالتش هم توضیح بدید که اگه بخوایم از فرآورده واکنش اول به مقدار مصرفی واکنش دهنده واکنش دوم برسیم تاثیر دادن بازده درصدی توی کسر تناسب باید چجوری باشه
خیلی ممنون
با سلام به شما دوست عزیز.
توی مسائل استوکیومتری، اگر بخوایم از روش تناسبی استفاده کنیم، به طور کلی بازده در کسر واکنش دهنده ضرب میشه نه فراورده.
اگر توی سوالی دو تا واکنش داشته باشیم و هر دو واکنش بازده درصدی جداگانه داشته باشن، چند حالت وجود داره:
1- درصورتی که بخوایم از واکنش دهنده واکنش اول به واکنش دهنده واکنش دوم برسیم، بازده هر واکنش رو در واکنش دهنده ی اون واکنش ضرب می کنیم
2- در صورتی که بخوایم از فراورده واکنش اول به واکنش دهنده واکنش دوم برسیم، فقط باید بازده واکنش دوم رو در واکنش دهنده واکنش دوم ضرب کنیم.
3- در صورتی که بخوایم از واکنش دهنده واکنش اول به فراورده واکنش دوم برسیم، در صورتی که واکنش ها عضو مشترک داشته باشن، فقط کافیه بازده واکنش اول رو در واکنش دهنده واکنش اول ضرب کنیم.
4- در صورتی که بخوایم از فراورده واکنش اول به فراورده واکنش دوم برسیم، نیازی به تاثیر هیچ کدوم از بازده ها نیست.
.البته توضیحاتی که دادم حالت کلی داره و با توجه به مفهوم سوال ممکنه استراتژی حل یه چیز دیگه باشه، بهتر بود متن سوالتون رو در پاسخ به توضیحاتم ارسال کنید تا بهتر بتونم راهنماییتون کنم
موفق باشید.
سلام استاد خسته نباشید چندتا سوال داشتم اینکه:
1: میتونیم بگیم تمام مولکول های الی دو قسمت قطبی و ناقطبی دارن؟
۲:توی فیلم تدریستون گفتین اگر هر چند تا اتم مرکزی داشتیم یکی درنظر میگیریم و نگاه میکنیم ببینیم آیا نقطه داره یا نه. اگر یک اتم مرکزی نقطه داشته باشه و یکیش نقطه نداشته باشه اون موقع چیکار کنیم؟
3: وقتی میگیم مثلا بخش قطبی صابون در آب حل میشود یعنی جهت گیری میکنه یا با آب پیوند تشکیل میده؟ یا مثلا وقتی میگیم بخش ناقطبی اش در چربی حل میشه این لفظ حل شدن یعنی چی؟ یعنی بخش نا قطبی چربی با بخش ناقطبی صابون پیوند تشکیل میده یا چجوری میشه؟
ممنون از توجه و پاسخگوییتون
سلام به شما دوست خوبم.
پاسخ سوال اولتون: خیر. چون هیدروکربن ها هم ترکیب آلی محسوب میشن و بخش قطبی ندارن.
پاسخ سوال دوم: بله. اگر دو تا اتم مرکزی داشته باشیم و فقط یکی نقطه داشته باشه، اون موقع باز هم مجموعشون رو نقطه دار فرض می کنیم.
پاسخ سوال سوم: منظور از حل شدن یعنی تشکیل نیروی جاذبه بین مولکولی! پیوند کوالانسی یا یونی تشکیل نمیشه بلکه نیروی جاذبه بین مولکولی بینشون تشکیل میشه.
موفق باشید
سلام استاد
استاد مطالب مورد نیاز فصل ۱ شیمی دوازدهم چیه؟
با سلام به شما دوست خوبم.
پیش نیازهای ضروری فصل اول شیمی دوازدهم عبارت اند از:
1-مبحث گروه های عاملی به خصوص کربوکسیلیک اسیدها و استرها از فصل دوم و سوم شیمی یازدهم
2- واکنش استری شدن و آبکافت استر از فصل سوم شیمی یازدهم
3- مسائل انواع غلظت (به خصوص غلظت مولی) از فصل سوم شیمی دهم
4- مبحث استوکیومتری یک ماده و استوکیومتری واکنش از فصل اول و دوم شیمی دهم + فصل اول شیمی یازدهم
موفق باشید
سلام استاد خسته نباشید
خداخیرتون بده پکیج نخبگانتون عالیه
استاد توی پیوند با زندگی فصل 2 دهم توی جزوه نوشتید در اثر انحلال نیتروژن دی اکسید (NO2) در آب نیتریک اسید (HNO3)تولید می شود و این معادله را براش نوشتید :
NO2+H2O——-> H2+HNO3
خوب الان این معادله از نظر موازنه مشکل داره چون سمت چپ(واکنش دهنده ها) 2 تا هیدروژن داریم و سمت راست(فراورده ها) 3 تا هیدروژن
ممنون میشم این قضیه رو برای من شرح بدید که مشکل از کجاست
بازم ممنونم
سلام به شما دوست خوبم. ممنون از نظر پرمهر شما. امید هست که با پیشروی با آموزش ها بدرخشید.
در هر جای شیمی، هر زمان مشاهده کردید که یک واکنش به شما دادن و ضریب همه مواد «یک» بود به این معنی نیست که اون واکنش الزاما موازنه شده باشه! در واقع زمانی که ضریب همه مواد «یک» باشه، این احتمال وجود داره که اون واکنش «خام یا اصطلاحاً موازنه نشده» باشه. در این صورت حتماً باید موازنه بودن هر عنصر رو در دو طرف چک کنید. اگر مشاهده کردید که تعداد برخی عنصرها در دو طرف برابر نیست، یعنی واکنش موازنه نشده بوده و شما باید موازنه اش کنید.
این نکته حتی توی آزمون های آزمایشی و یا کنکور سراسری صدق می کنه یعنی اگر در سوالی واکنشی به شما دادن که ضریب همه مواد یک بود، این امکان وجود داره که واکنش موازنه نشده باشه و موازنه کردنش بر عهده شما باشه.
موفق باشید
سلام وقتتون بخیر . جا داره تشکر کنم از تدریس عالی و بی نظیرتون 🌹🙏
ببخشید استاد مگه حجم مولی گاز ها در صورتی که دما و فشار یکسان باشن بنا بر داشتن مول های یکسان با هم برابر نیست؟
پس چرا توی حل تست های استوکیومتری زمانی که گازها مول های نابرابر داشته باشند، ما حجم مولی اونها رو با هم برابر در نظر میگیریم و از دو طرف معادله ی کسرهای پیش ساخته خط می زنیم؟
سلام به شما دوست خوبم. ممنون از نظر لطف شما…
حجم مولی گازها، طبق تعریف، به مقدار حجمی که یک مول از اون گاز در دما و فشار مشخص اشغال می کنه گفته میشه!
به عبارت دیگه، حجم مولی گازها فقط به دما و فشار بستگی داره نه مقدار مول اولیه گازها! به طوری که در دما و فشار یکسان، حجم مولی گازها با هم یکسان هست.
مثلا اگر دو گاز «آ» و «ب» داشته باشیم و هر دو گاز در دمای 20 درجه سانتی گراد و فشار 5 اتمسفر قرار بگیرند، حجم مولی این دو گاز با هم برابره، و اصلا اهمیتی نداره که مقدار اولیه هر کدوم از گازها چقدر باشه! مثلا اگر مقدار گاز «آ» 10 مول باشه و مقدار گاز «ب» 15 مول باشه، باز هم حجم مولی این دو گاز در دما و فشار گفته شده با هم برابره. چون حجم مولی گازها فقط به دما و فشار بستگی داره!
موفق باشید
سلام استاد خسته نباشید یک سوال کوتاه داشتم اینکه در مبحث شماره گذاری الکان های شاخه دار گفتین از طرفی شروع میکنیم که به اولین شاخه نزدیک باشه. حالا اگر دو تا شاخه داشته باشیم که از هر طرف با شماره یکسانی به اون شاخه ها رسیدیم، شاخه دوم رو ملاک قرار میدیم . و گفتین اگر از هر دو طرف به دومین شاخه هم با شماره یکسانی رسیدیم شاخه ای رو انتخاب میکنیم که حرف اولش در الفبای لاتین مقدم تره.
حالا سوالی که پیش اومده برام اینه که: اگر آلکان ما به گونه ای باشه که از هر دو طرف، هم با شماره یکسانی به شاخه اول رسیدیم و هم با شماره یکسانی به شاخه دوم رسیدیم، اون موقع، تقدم الفبایی رو برای شاخه های اول در نظر میگیریم یا برای شاخه های دوم؟ مثلا یه طرف شاخه اول متیل داره، شاخه دوم اتیل و طرف دیگه شاخه اولش اتیل هست، شاخه دومش متیل! شماره گذاری رو از کدوم طرف باید انجام بدیم؟
سلام دوست من

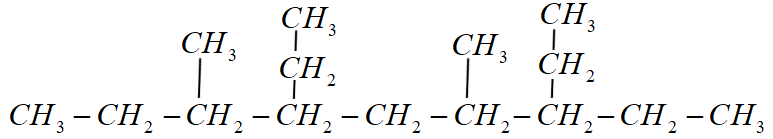
اگر فاصله نخستین شاخه فرعی از دو سر زنجیر اصلی یکسان باشه، همچنین فاصله دومین شاخه فرعی هم از دو طرف یکسان باشه و شاخه دیگری نداشته باشیم، باید شماره گذاری رو از سمتی انجام بدیم که اگر عددهای مربوط به شاخه های فرعی رو به ترتیب کنارهم بچینیم، عدد کوچکتری به دست بیاد.
یه مثال میزنم. فرض کنید یه آلکان داریم با مشخصات زیر:
دو تا حالت برای شماره گذاری وجود داره!
اگر از سمت راست شماره گذاری کنیم، نام آلکان ما به صورت زیر درمیاد:
3و6- دی اتیل 4و7-دی متیل نونان
اگر از سمت چپ شماره گذاری کنیم، نام آلکان ما خواهد شد:
4و7-دی اتیل 3و6-دی متیل نونان
قطعا حالت اول درسته! چون اگر شماره ها را به ترتیب کنار هم بچینیم، عدد کوچکتری حاصل میشه.
در حالت اول، ترتیب اعداد خواهد شد: 3647
و در حالت دوم، ترتیب اعداد خواهد شد: 4736
با سلام استاد وقت بخیر یه سوالی داشتم با توجه به تدریس بی نظیرتون فرمودین که هر چی عنصری تعداد لایه های اتمیش بیشتر باشه شعاع بیشتری داره و هر چی شعاع بیشتر باشه خصلت فلزی هم بیشتره ولی وقتی سدیم و و قلع رو مقایسه میکنم قلع ۵ لایه داره ولی سدیم ۳ لایه ولی خب خصلت فلزی سدیم بیشتر از قلع چون در گروه ۱ قلیایی هست چطور این امکان داره؟؟ یا مثلا گفتین که فلزات قلیایی بیشتر از قلیایی خاکی قلیایی خاکی هم بیشتر واسطه هست حالا اگر سرب رو با کادمیم بخوایم مقایسه کنیم چی فلزاتی که در دسته p جدول هستن واکنش پذیریشون نسبت به بقیه فلزات چجوریه؟
با سلام به شما دوست خوبم. با توجه به عکسی که در همین پاسخ ضمیمه شده، شعاع اتمی سدیم از قلع بیشتره. (برای مشاهده عکس اینجا کلیک کنید)
در ضمن مقایسه شعاع در حیطه کنکور فرم مشخصی داره و خارج از اون فرم به هیچ عنوان سوال داده نمیشه. چون قواعد مقایسه شعاع تمی عناصر و همچنین مقایسه خصلت فلزی یا نافلزی عناصر فقط به مواردی که در دبیرستان میخونید خلاصه نمیشه و اگر تخصصی تر بخواید یاد بگیرید در کتاب های دانشگاهی باید به دنبالش بگردید. ولی در حیطه کنکور همون قواعد ساده ای که آموزش داده شده کفایت می کنه تا مقایسه شعاع و یا مقایسه خصلت فلزی و نافلزی رو انجام بدید.
در کل یاد بگیرید هر چه موقعیت عنصر بالاتر و راست تر باشه، شعاع کمتری داره / و هر چه موقعیت پایین تر و چپ تر باشه، شعاع بیشتری داره.
و مطمئن باشید طراح کنکور هرگز سوالی رو مطرح نمی کنه که از این چارچوب خارج باشه چون قواعدش رو شما در حیطه کنکور و دبیرستان یاد نمیگیرید.
برای مشاهده قاعده مقایسه شعاع اتمی اینجا کلیک کنید
برای مشاهده قاعده مقایسه خصلت فلزی و نافلزی اینجا کلیک کنید
سلام استاد، نحوه بدست آوردن سریع تعداد الکترون های اشتراکی و پیوند ها در یک پیوند کووالانسی چیه؟
با سلام. پاسخ شما به صورت ویدیویی ضبط شد و در لینک زیر قرار گرفت. برای مشاهده پاسخ سوالتان، روی لینک زیر کلیک کنید:
https://konkurium.com/landing/formool-co.mp4
استاد من واقعا و واقعا عاشق تدریس شما شدم و فقط شیمیو با ویدیوی شما میتونم بفهمم.قراره چند روز بعد دوره نخبگان شیمیو کامل بخرم ولی واقعا نمیدونم چه دوره ای رو برای فیزیک و ریاضی و هندسه م انتخاب کنم که مثل شما هم درسنامه داشته باشه و هم کنکور محور باشه. . .
میتونین جایی رو معرفی کنین؟یا خودتون تدریس میکنین؟
با سلام به شما دوست خوبم. علاقه مندی شما باعث خوشحالیه. امیدواریم توی دوره درخشش شما رو بیشتر از پیش ببینیم.
در رابطه با دروس دیگه توصیه می کنیم نمونه تدریس اساتید رو ببینید، با هر کدوم که تونستید ارتباط بهتری برقرار کنید از همون استاد استفاده کنید. موفق باشید
سلام استاد ببخشید این روزا خیلی سوال میپرسم.
سوالم اینه: دلیل اینکه جرم اتمی میانگین به دست اومده توسط ما با جرم اتمی میانگین در جدول تناوبی تفاوت اندکی داره چیه؟
۱_جرم اتمی رو برابر عدد جرمی در نظر گرفتیم در حالی که دقیقا برابر نیستن.
۲_وجود ایزوتوپ های مختلف که ما اونارو حساب نکردیم تو مسائل.
کدوم یکی از این دو جواب درست تره در کنکور؟
متشکرم…
سلام به شما دوست خوبم.
علتش به این دلیل هست که جرم اتمی عنصرها و همچنین درصد فراوانی که توی سوال به ما داده میشه به صورت تقریبی هست و همین عامل باعث میشه گاهی اوقات جرم اتمی میانگینی که ما حساب می کنیم با مقدار جدول کمی تفاوت داشته باشه. در بین مواردی که ذکر کردید، مورد اول درست تره.
موفق باشید
سلام استاد خسته نباشید.من تو یه تستی دیدم فرمول ترکیبات هیدروژن دار گروه ۱۶ رو به این شکل نوشته:XH2 منم غلط حسابش کردم رفتم پاسخنامه و دیدم درست حساب کرده.در حالی که ما میدونیم درستش H2X هست.آیا اشتباه ازپاسخنامه هست یا من؟
خیلی ممنونم ازتون که وقت میزارید و سوالامون رو پاسخ میدید.☘️🙏
سلام به شما دوست عزیز.
فرمول ترکیبات هیدروژن دار گروه 16 به صورت H2X هست و در تست های کنکور این فرمول رو در نظر میگیریم. اما تست هایی که کنکوری نیستن و مربوط به سایر مولفان هستن، سلیقه ای عمل می کنن؛ یعنی گاهی ممکنه بعضی طراح های چنین تست هایی، فرم XH2 رو هم درست در نظر بگیرن.
سلام مجدد استاد ببخشید طیف نشری خطی سدیم چند تا خط تو ناحیه مرئی داره؟ ۱ یا ۷ تا
متشکرم.
با سلام. براساس ویرایش جدید کتاب درسی دهم در صفحه 23، طیف نشری خطی سدیم شامل 7 خط رنگی در ناحیه مرئی هست.
منظور از محدوده مرئی طول موج بین حدود 400 نانومتر تا 700 نانومتر هست. هر خطی که در این محدوده باشه، به عنوان خط مرئی حساب می کنیم.
سلام استاد وقتتون بخیر.
عدد آووگادرو یکا داره؟یکاش ازکجا و چجوری به دست میاد؟
ممنون
سلام وقت شما هم بخیر.
بله یکای عددآووگادرو «یک بر مول» یا «مول به توان منفی یک» هست.
از اونجا که عددآووگادرو به ازای یک مول از ماده تعریف میشه چنین یکایی رو براش تعریف می کنیم.
سلام استاد وقتتون بخیر
ببخشید این که میگن توی تعادل واکنش به سمت چپ جابهجا میشه یعنی چی؟
با سلام و وقت بخیر.
اگر در واکنش های تعادلی در اثر یک عامل خارجی مثل تغییر دما، تغییر فشار و یا تغییر غلظت، تعادل بهم بریزد آن واکنش براساس قانون لوشاتلیه، برای برقراری مجدد تعادل یا در جهت رفت بیشتر پیشروی می کند یا در جهت برگشت.
اگر واکنش در جهت رفت پیشروی بیشتری داشته باشد اصطلاحا می گوییم تعادل به سمت راست جا به جا شده است و اگر واکنش در جهت برگشت پیشروی بیشتری داشته باشد، می گوییم تعادل به سمت چپ جا به جا می شود.
سلام استاد وقتتون بخیر
ببخشید با توجه به اینکه طراح توی تست شیمی جلوی سوال توی پرانتز جرم مولی اتم ها رو به ما میده آیا ما لازمه جرم مولی اتم ها رو هم حفظ باشیم؟
با سلام و وقت بخیر.
قطعا در مسائل، جرم مولی ها به شما داده خواهد شد. اما در سایر تست ها، خصوصا تست های تحلیلی که قرار است دو یا چند ماده را مقایسه کنید، بهتر است برای سرعت عمل بالاتر، جرم مولی اتم های پرتکرار و متداول را حفظ نمایید. هر چند در صورت تمرین و تکرار زیاد مسائل، خود به خود جرم مولی اتم ها را حفظ خواهید کرد. در صورتی که آگاهانه آن ها را به خاطر بسپارید احتمال فراموشی کمتر خواهد بود.
موفق باشید.
با سلام خسته نباشید استاد . قبل ار پرسش سوال ممنون بابت تدریس حرفه ای و مفیدتون سوال داشتم خدمتتون
اینکه شما فرمودین که فرمول کتون ها از CnH2nO بدست میاد ولی زردچوبه که گروه کتون داره اگر ۱۵ کربن رو که در نظر بگیریم تعداد هیدروژن ها از فرمول پیروی نمی کنه علتش به خاطر چیه؟ و به استثنا آیا باید حفظ کرد؟ همچنین دارچین که گروه آلدهیدی داره اما باز هم تعداد هیدروژن از فرمول پیروی نمی کنه چرا؟
با سلام به شما دوست خوبم.
طبق آموزش های فصل سوم شیمی یازدهم، یاد میگیریم که فرمول عمومی کتون ها به صورت CnH2nO است. اما باید توجه داشته باشید که منظور از کتون ها در این فرمول، فقط کتون های «راست زنجیر و سیرشده» است! یعنی کتون هایی که فقط «یک عامل کتونی» داشته باشند و هیچ گروه عاملی دیگری نداشته باشند. همچنین ساختار آن ها به صورت راست زنجیر باشد و هیچگونه حلقه و یا پیوند دوگانه یا سه گانه ای میان کربن ها وجود نداشته باشد.
چنانچه کتون مورد نظر راست زنجیر و سیرشده نباشد، از فرمول بالا پیروی نمی کند و ناچاریم فرمول آن را حفظ کنیم.
این نکاتی که در بالا ذکر شد برای فرمول عمومی آلدهیدها و سایر گروه های عاملی که در فصل سوم می خوانید نیز صدق می کند.
موفق باشید
سلام استاد ببخشید یک سوال داشتم
اینکه میشه لطفا تفاوت سوختن و اکسایش رو بگید ممنون میشم 🙂
با سلام و وقت بخیر.
واکنش سوختن به واکنش سریع یک ماده با اکسیژن می گوییم که برای انجام شدن آن نیاز به جرقه یا شعله وجود دارد.
واکنش آکسایش به واکنش آهسته یک ماده با اکسیژن می گوییم که نیازی به وجود شعله یا جرقه برای انجام واکنش نیست.
موفق باشید
سلام
ببخشید من یک سوال از شکل کتاب درسی دوازدهم داشتم اگر امکان داره من رو راهنمایی کنید.
در فصل سوم کتاب دوازدهم یه شکل (نقشه پتانسیل الکتروستاتیکی) از کربن دی اکسید رسم شده که در آن ابر الکترونی C از 2 تا O کناری بیشتر است.
آیا شکل کتاب اشتباه هست یا بخاطر اینکه C دو بار جزئی + دارد و هر کدام از O ها 1 بارجزئی – ، ابر الکترونی کربن نسبت به اکسیژن های اطرافش بزرگتر رسم شده است. امیدوارم منظورم رو درست بیان کرده باشم
با تشکر
با سلام. با توجه به نکات فصل سوم شیمی دوازدهم، اندازه ابر الکترونی اطراف یک اتم، با شعاع آن اتم متناسب است. اتمی که شعاع بزرگتری دارد، اندازه ابر الکترونی آن نیز بزرگتر دیده خواهد شد.
اما رنگ قرمز یا آبی که در نقشه پتانسیل الکترواستاتیکی مطرح می شود ربطی به اندازه ابر الکترونی ندارد؛ به عبارت دیگر در بحث نقشه پتانسیل الکتروستاتیکی کاری به اندازه ابرالکترونی نداریم، بلکه فقط به احتمال حضور الکترون های پیوندی کار داریم! به طوری که هر چه احتمال حضور الکترون های پیوندی بیشتر باشد رنگ قرمز و هر چه احتمال حضور الکترون های پیوندی کمتر باشد رنگ آبی را به ابرالکترونی نسبت می دهیم.
بر اساس نکات شیمی یازدهم می دانیم اتم C شعاع بزرگتری نسبت به اتم O دارد. همین عامل باعث می شود که ابرالکترونی آن فضای بزرگتری از ابرالکترونی اکسیژن را اشغال کند. در رابطه با سایر شکل ها نیز همین نکته صادق است.
موفق باشید
سلام استاد خسته نباشید ببخشید یک سوال داشتم من هر کاری می کنم نمی توانم جواب این موازنه را پیدا کنم اگر میشه کمکم کنید
NA2CO3 + Ca(NO3)2 NA2NO3 + CaCO3
با سلام.
توجه داشته باشید معادله به صورت اشتباه نوشته است. طبق قواعد فرمول نویسی فرمول سدیم نیترات به صورت NaNO3 است. بنابراین فرم درست معادله شما به صورت زیر خواهد بود:
Na2CO3 + Ca(NO3)2 ===> NaNO3 + CaCO3
حال به راحتی می توانید آن را موازنه کنید.
توصیه می شود با دقت آموزش مربوط به موازنه را از سایت ببینید. جهت مشاهده این آموزش اینجا کلیک کنید
سلام استاد
ببخشید هیچ وقت این سوالم برطرف نشده که چرا نمیتونیم مولکول کربن دواتمی داشته باشیم و چرا بین شون نمیتونه پیوند ۴ گانه شکل بگیره؟
با سلام به شما دوست گرامی.
سوالی که پرسیدید در حیطه المپیاد است نه کنکور!
در حیطه المپیاد باید بگوییم که اخیراً دانشمندان وجود پیوند چهارگانه کربن-کربن را در مقاله ای به اثبات رسانیده اند. مولکول C2 وجود دارد که در آن پیوند چهارگانه بین دو اتم کربن موجود است اما این مولکول به اندازه سایر ترکیبات کربن پایدار نیست و سریعاً از بین می رود. برای اینکه این موضوع را بهتر درک کنید باید با واژه «اوربیتال» آشنایی داشته باشید اما این واژه در کتاب درسی نظام جدید وجود ندارد!
دلیل اینکه پیوندهای چهارگانه متداول نیستند شکل فضایی خاص نوعی اوربیتال است که به طور کلی اجازه تشکیل چهار پیوند بین دو اتم را نمی دهد.
موفق باشید
سلام استاد دانش روز تون بخیر 🌹🌸🌹🌸
خواستم بگم کووالانسی _واندروالسی_هیدروژنی چه فرقی باهم دیگه دارند؟
کوالانسی و هیدروژنی پیوند بین مولکولی اند؟
واندروالسی هم نیروی بین دو تا مولکول است؟
ممنون میشم در این مورد راهنماییم کنید.
خیالت تونم راحت تمام آموزش های سایت رو هم دیدم اما خب هنوز به پاسخ این سوال نرسیدم.🙄
سلام و درود. وقت شما هم بخیر
پیوند کووالانسی ، پیوند بین دو اتم است.
اما پیوند هیدروژنی و نیروی واندروالسی، نیروی جاذبه بین دو مولکول محسوب می شود.
موفق باشید🌹